蛋白质组学以及磷酸化组学都是目前应用非常广泛的高通量组学技术,但在以往的研究中,通常是二选一的模式,从蛋白质层面或者磷酸化蛋白质层面单独展开研究。
随着蛋白质组学和磷酸化组学的关联分析逐渐被应用,两个层面的变化差异远比我们想象的要显著。为帮助大家更好地认识到蛋白质功能研究的意义以及准确选择研究方法,我们深入总结出蛋白质组与磷酸化组学联合的意义、方法以及结果,希望给即将开展的老师提供帮助。
从蛋白质功能层面进行研究,需要从蛋白质组和磷酸化蛋白质组两个层面同时进行开展的理由如下:
单一磷酸化蛋白质组学研究方法,无法观测到蛋白质本底的变化
案例:Multi-layered proteomic analyses decode compositional and functional effects of cancer mutations on kinase complexes.
NATURE COMMUNICATIONS | (2020)

作者以肿瘤驱动基因Dyrk2为例,利用了DIA/SWATH蛋白质组学、DIA/SWATH磷酸化蛋白质组学等多层组学技术,系统揭示了Dyrk2基因突变是如何影响下游蛋白质表达及磷酸化修饰的分子机制,发现磷酸化而非蛋白质组在宿主扰动过程中起到了关键的作用。
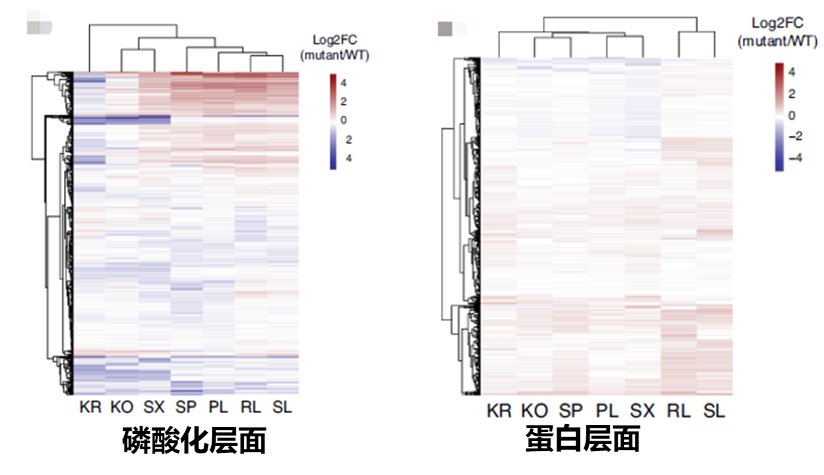
蛋白层面和磷酸化层面均参与调控生物学过程,共同影响生物学功能
案例:Sleep-wake cycles drive daily dynamics of synaptic phosphorylation.
Science. 2019

在该篇关于昼夜节律变化的研究显示:前脑突触神经元中的磷酸化修饰变化明显独立于蛋白丰度的变化,且磷酸化水平的平均振幅比蛋白质水平的平均振幅大10倍。说明节律扰动的蛋白组与磷酸化组差异相互独立,共同在基础生理功能中起到调控作用。
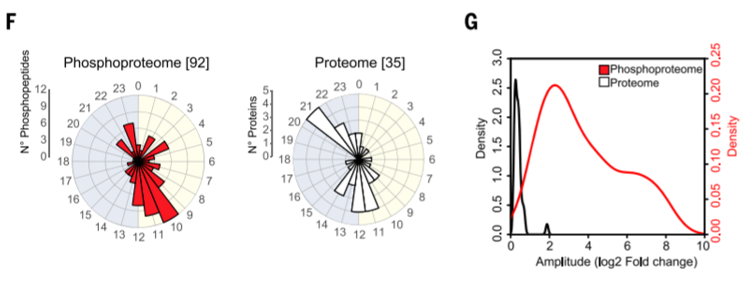
图2 昼夜节律变化中的蛋白质组与磷酸化组扰动情况
类似文章案例在肿瘤、神经、发病机制研究等等领域中还有很多,因此蛋白质组+磷酸化蛋白质组可谓是蛋白质水平上进行机理研究的“黄金搭档”。两者联合可从更多维度分析生物反应的机制,通过对修饰位点的挖掘更好地解释表型背后的分子调控网络。二者联合使用,总结起来有以下三点优势:

基于以上研究目标,中科新生命特推出黄金组合——“蛋白质组+磷酸化蛋白质组联合分析”
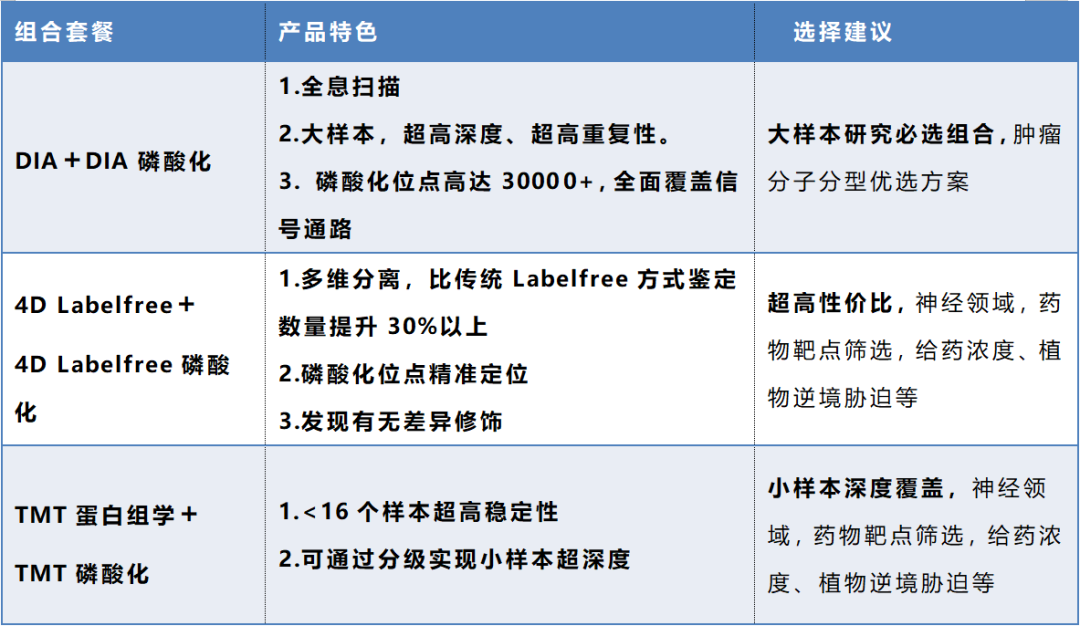
通过上述组合选择,配合下方数据,对于“多维”蛋白质功能研究一定有更加系统和全面的认识。
#01 蛋白质组学和磷酸化组学整合功能/通路富集分析——从更全面的角度剖析调控网络及机制
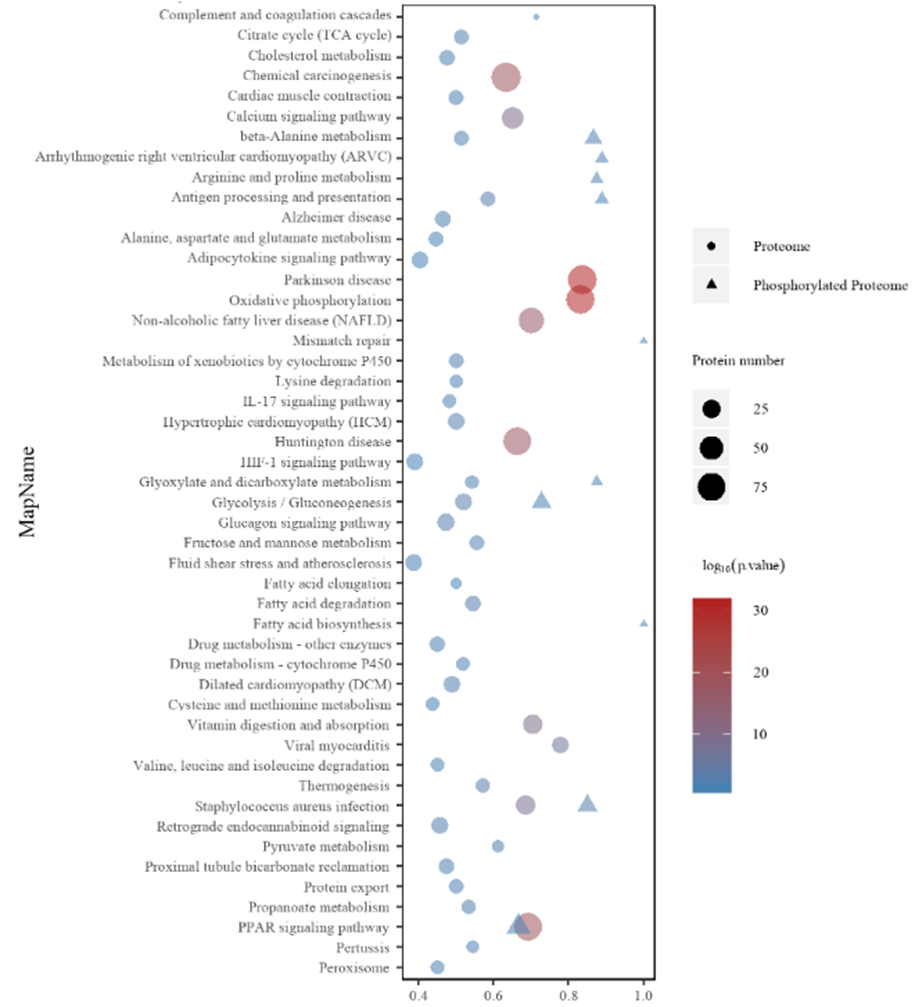
从上图可以看到蛋白质组(○)与磷酸化蛋白质组(△)的KEGG富集通路存在很大差异。其中,蛋白质组与磷酸化组分别具有特异的富集通路,同时两者也存在共同富集的通路 该分析从全局角度展示了蛋白表达与修饰调控通路的异同。
#02 蛋白表达与位点修饰差异比较分析——区分表达与修饰谁起主导调控作用
单独的磷酸化组学检测不能区分修饰的差异是由本身修饰程度差异还是蛋白本底表达差异造成的。通过两个组学结果的结合展示(如下表),可以同时给出蛋白修饰层面的差异倍数以及蛋白表达差异倍数,从而区分位点磷酸化修饰的特异性。

#03 激酶注释及激酶底物整合分析——挖掘调控网络的关键节点。
激酶在磷酸化修饰过程中起到了非常核心的调控作用。激酶的表达、激酶的磷酸化修饰水平的改变会直接调节其它激酶和下游蛋白底物的磷酸化修饰程度。从下图的蛋白互作网络分析图表可以看到,激酶Ckd1在网络中具有较高PPI degree值,说明它占到比较核心的调控节点作用。
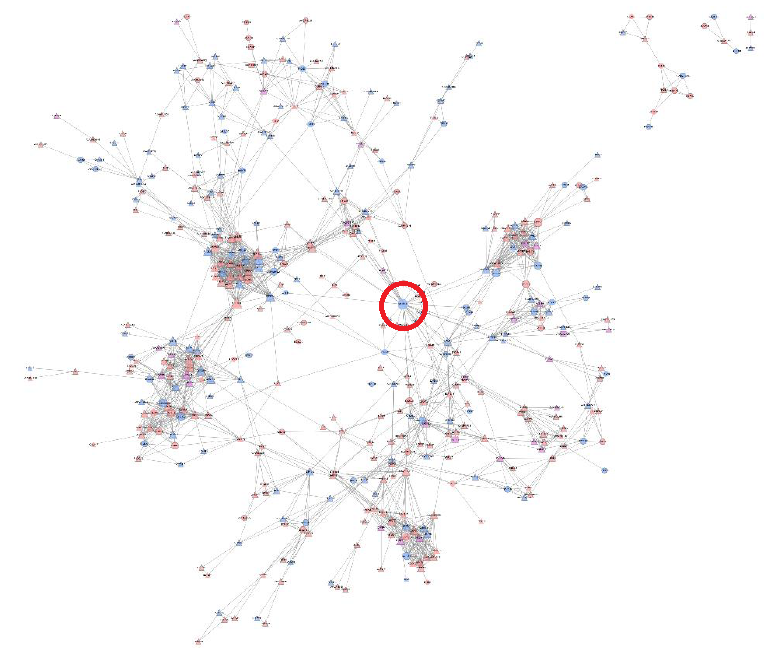

定量蛋白质组与磷酸化蛋白质组关联分析已成为CNS发文热点,两者关联分析也是越来越深入。如何将二者更好的联合分析对于基础科研显得尤为重要。
