HEK293细胞在生物制药领域的应用
HEK293细胞系是人胚胎肾细胞系,具有与人类细胞相似的翻译后修饰系统,能够生产出更接近天然人类蛋白的重组蛋白。其在生物制药领域应用广泛,尤其是在细胞和基因治疗(CGT)产品生产中占据重要地位。许多治疗性病毒载体,如慢病毒、腺相关病毒等,都在 HEK293 细胞中生产。随着CGT领域的迅速发展,HEK293及其衍生细胞的应用前景将更加广阔。
残留DNA风险及法规监管要求
WHO和各国药物注册监管机构均对生物制品中外源宿主DNA残留提出了监测和控制要求,以确保生物制品的安全性及质量可控性。
WHO和美国FDA现行指导方针推荐成品中残留DNA不高于10 ng/剂,美国FDA还指出生物制品宿主细胞DNA残留DNA不高于100 pg/剂。欧洲药典通则规定生物制品残留DNA限度大多为不超过10 ng/剂。中国药典2020年版三部规定,以细胞基质生产的生物制剂外源宿主细胞DNA残留量不能超过100 pg/剂,以细菌或真菌基质生产的疫苗DNA残留量不能超过10 ng/剂。
除需对DNA的残留量进行控制外,DNA残留片段大小分布也是确定其相关风险因素的重要指标。有研究表明,一个功能基因至少在200 bp以上,因此大于200 bp有可能会有一定的致病性,而且残留DNA片段越大,生物制品的风险等级越高。
SV40LTA & E1A 残留 DNA 的法规监管要求
HEK293T细胞是HEK293细胞系的衍生物,通过表达一个温度敏感的SV40大T抗原突变体而建立。SV40是一种致瘤病毒,其大T抗原(LTA)序列和腺病毒E1A序列具有潜在安全性风险。CDE(国家药品监督管理局药品审评中心)颁布的相关指导原则要求,对包装病毒载体用细胞库(如HEK293T细胞)携带的Adv E1A序列和SV40大T 抗原序列等具有潜在安全性风险的特定转化序列,均应进行残留控制。
HEK293相关残留检测解决方案
//
HEK293宿主残留检测
试剂盒线性范围为:30fg/μL~300pg/μL,R2=1,扩增效率为100.45%,各浓度检测值CV<15%。
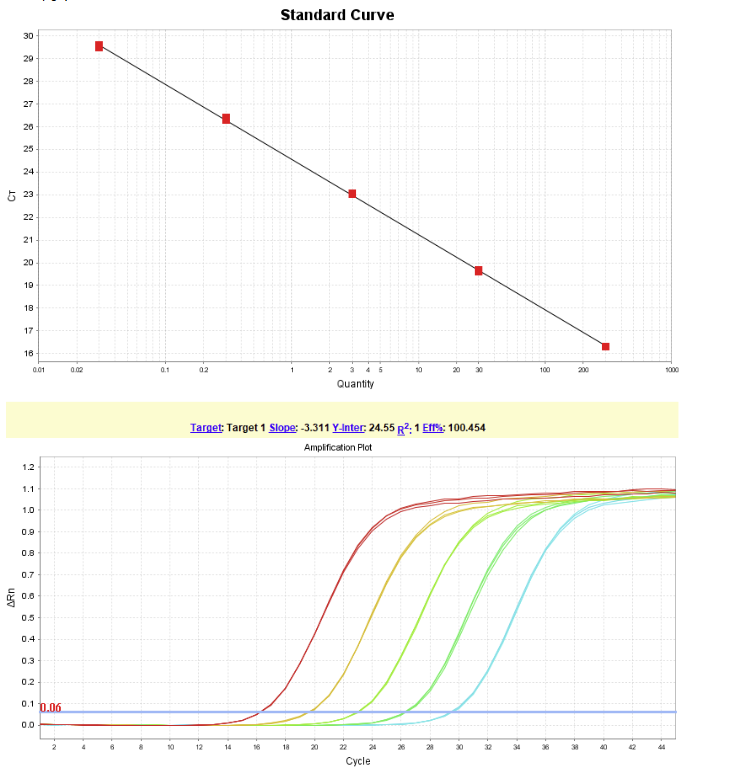
图 1.HEK293 DNA标曲线性图(上)和扩增曲线线性图谱(下)
//
HEK293宿主残留片段分析
试剂盒含有四种不同长度的扩增片段:82 bp、133 bp、227 bp、515 bp,四片段线性范围均为30 fg/μL~300 pg/μL,R2>0.99,扩增效率在90%~110%之间,各浓度检测值CV<15%。

图2 .82 bp扩增曲线图谱(上)和133 bp扩增曲线图谱(下)

图3 .227 bp扩增曲线图谱(上)和515 bp扩增曲线图谱(下)
//
SV40LTA & E1A 残留检测
SV40LTA线性范围在1.8×101~1.8×105copies/μL,R2=1,扩增效率为100.25%,各浓度检测值CV<15%;
E1A线性范围在1.8×101~1.8×105copies/μL,R2=1,扩增效率为100.25%,各浓度检测值CV<15%。
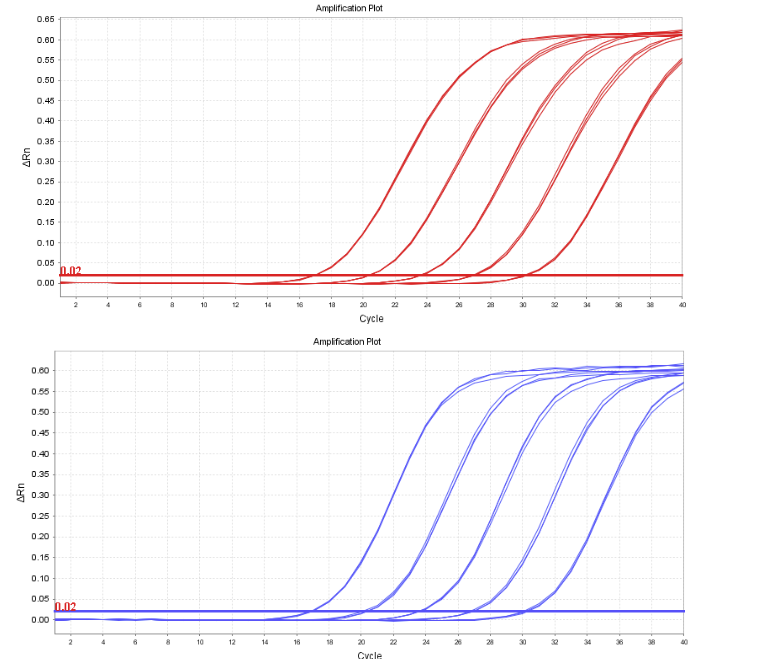
图4 .SV40LTA扩增曲线图谱(左)和E1A扩增曲线图谱(右)
产品特点
·
符合法规:按照法规要求进行全面验证,可提供验证报告;
·
保障品质:试剂盒原材料全自主研发,qPCR Mix等酶产品在超洁净酶工厂生产;
·
精密度高:批内重复性高,批间差异小;
·
专属性强:特异性检测不受其他外源基因组DNA干扰。
产品详情
|
产品名称 |
规格 |
货号 |
|
50T/100T |
41331ES |
|
|
4*50T/4*100T |
41316ES |
|
|
50T/100T |
41310ES |
|
|
50T/100T |
41321ES |
