01
细胞形态变化
脂质过氧化是铁死亡的核心驱动因素,因此,铁死亡细胞的形态变化主要出现在细胞富含脂质的生物膜上以及细胞中维持氧化还原平衡的线粒体中。其显著特征表现为质膜完整性丧失、细胞膜破裂、线粒体萎缩、线粒体外膜破裂、嵴减少或缺失和膜密度增加[15]。
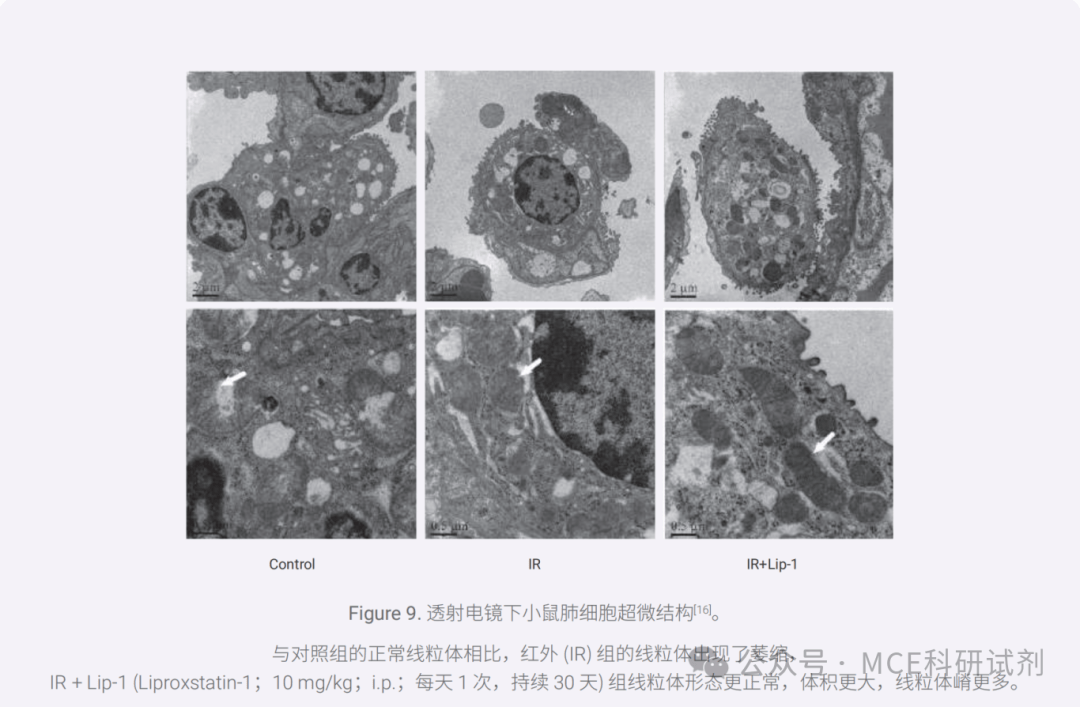
02
细胞代谢水平的变化
铁死亡与铁积累和脂质过氧化密切相关。其典型重要标志之一即为脂质过氧化物水平的升高,脂质过氧化的产物包括最初产生的磷脂氢过氧化物(PLOOHs)和随后产生的丙二醛(MDA)和 4 - 羟基壬烯醛(4-HNE),这些代谢物在损伤细胞膜结构及功能中起关键作用。
此外,过量的亚铁离子(Fe2+)可以产生过量活性氧(ROS),导致脂质过氧化,诱导铁死亡。同时,GSH 水平显著下降,导致细胞抗氧化能力减弱,进而加剧脂质过氧化物的积累,并诱导铁死亡。
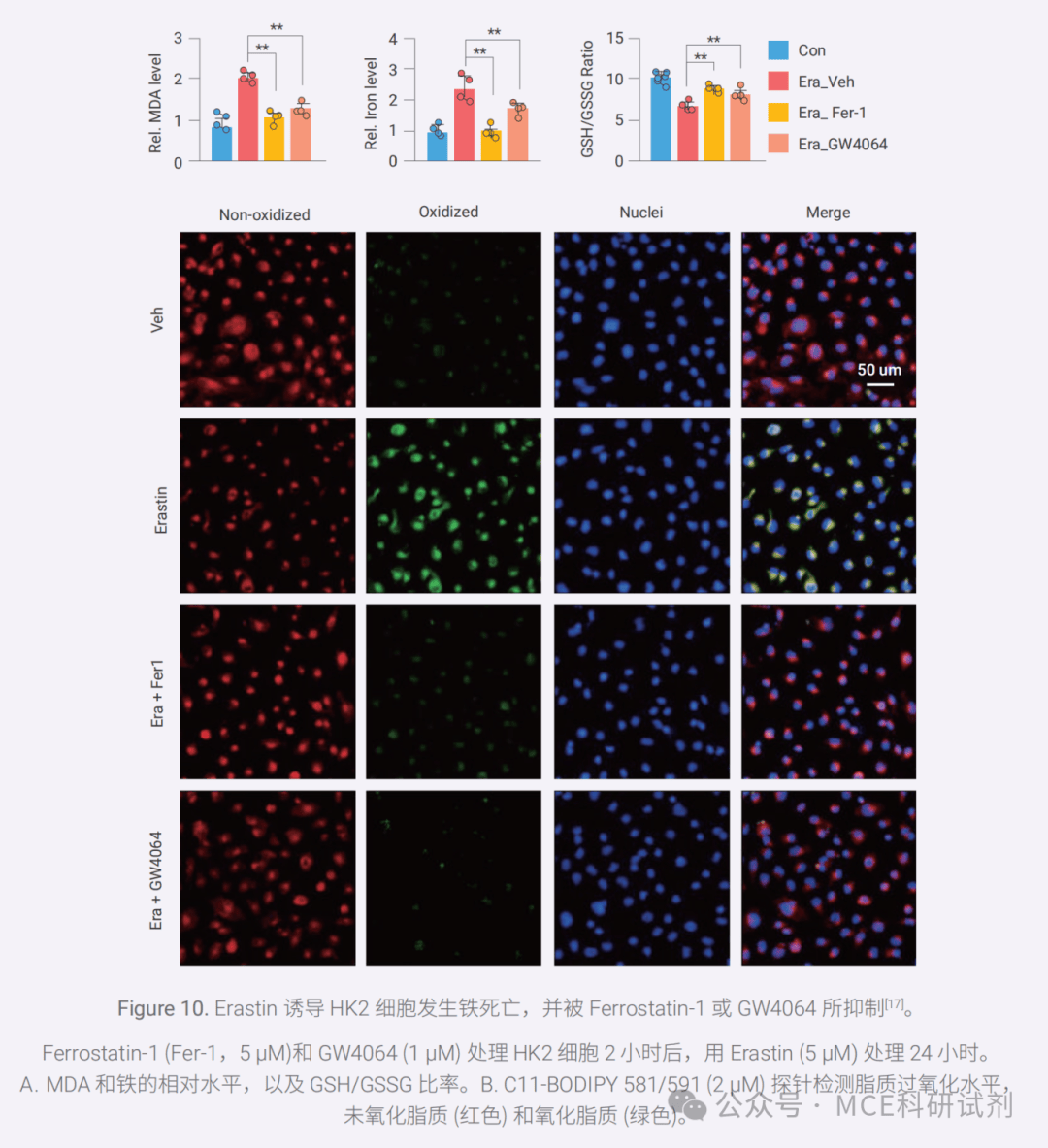
03
细胞分子水平的变化
铁死亡受到多种机制调控,主要分为过氧化代谢部分(如铁代谢途径和脂代谢途径) 和抗氧化部分 (如 System xc--GSH-GPX4 途径,AIFM2-CoQ10, GCH1-BH4, ESCRT-III 膜修复系统和 DHODH 途径)。
铁死亡发生时,会出现多种促氧化通路相关蛋白表达上调和抗氧化通路相关蛋白失调的情况。例如,GPX4 含量和活性下降,SLC7A11 下调;转铁蛋白受体(TFRC)表达上调以增加铁的摄取,ACSL4 表达增加来增强多不饱和脂肪酸(PUFA) 含量等。可通过 Western blot、免疫荧光、免疫组织化学,以及实时荧光定量 PCR 等技术来检测。
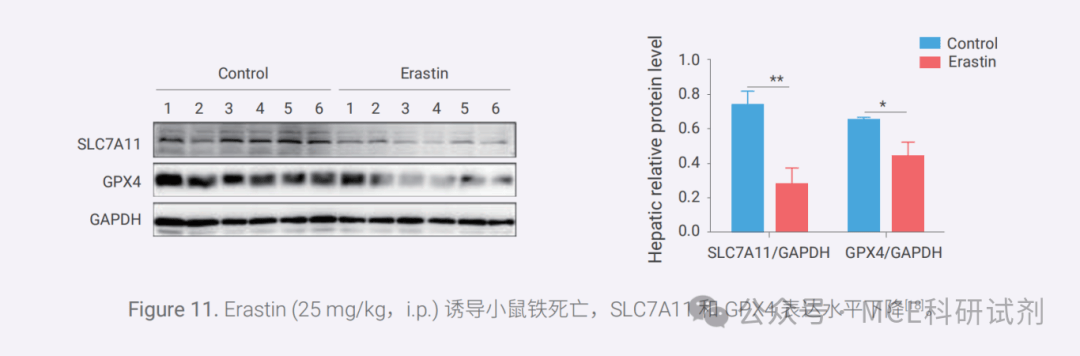
04
铁死亡和铜死亡的比较
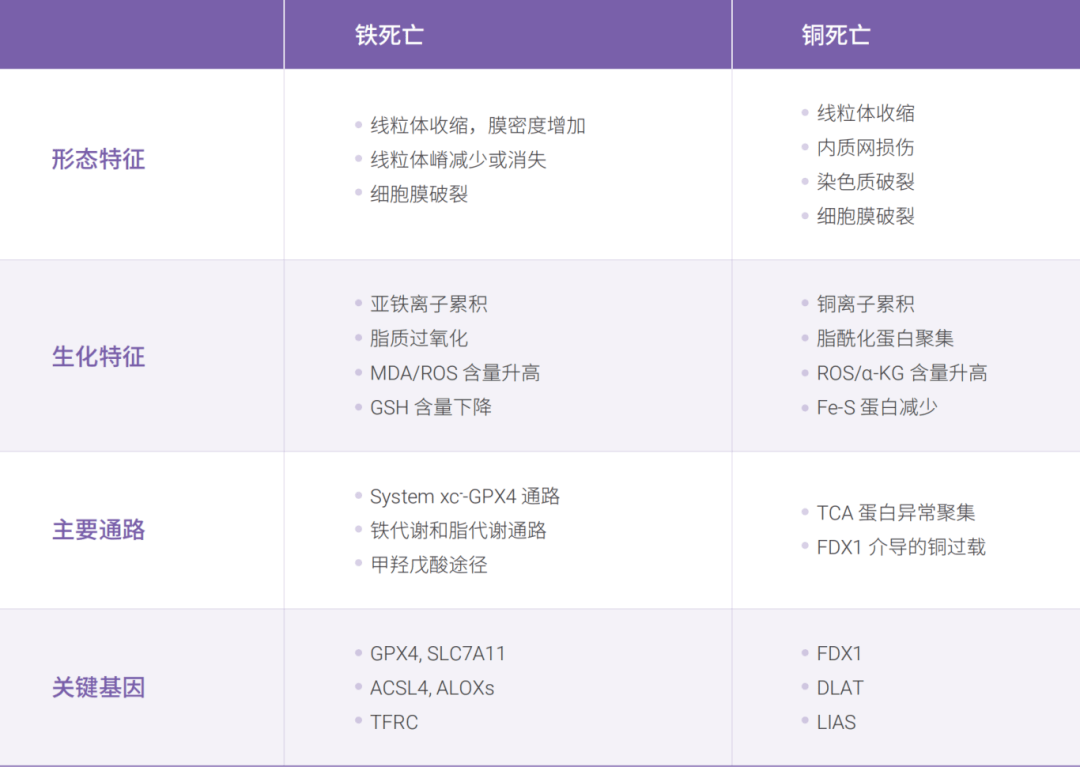
参考文献:
[15] Nanoscale Adv. 2023 Feb 14;5(5):1271-1290.
